Analýza krvných plynov u zvieracieho pacienta (I. diel) – význam, teória a odber vzoriek
Acidobázická rovnováha (ABR) a respiračné funkcie – poruchy a ich diagnostika
Poruchy acidobázickej rovnováhy (ABR) a respiračných funkcií (RF) sú bežným problémom u kritických pacientov (akútny alebo hospitalizovaný pacient). V manažmente takýchto pacientov je veľmi významná diagnostika na základe analýzy krvných plynov a jej správna interpretácia. Aj v portfóliu EM Medical nájdete možnosť, ktorou túto analýzu dokážete na Vašom pracovisku zabezpečiť – Analyzátor krvných plynov a elektrolytov WOODLEY Epoc Blood Analysis.
Acidobázická rovnováha (ABR) – stručný prehľad
Acidobázická rovnováha je rovnováha medzi príjmom a vylučovaním, resp. medzi tvorbou a neutralizáciou kyselín a zásad v organizme. Koncentrácia vodíkových iónov v mimobunkovej tekutine sa pohybuje okolo 40 mmol/l, čo zodpovedá hodnote pH 7,4. Aj pomerne malé výkyvy z tejto rovnovážnej hodnoty majú pre organizmus závažné následky, preto existujú systémy a mechanizmy, ktoré ju udržiavajú v stabilných hodnotách. Stálosť pH vnútorného prostredia sa tiež označuje ako izohydria.
Poruchy metabolickej acidobázickej rovnováhy organizmu môžu viesť k:
- Alteráciám kardiovaskulárnych, respiračných a neurologických funkcií organizmu
- Alterovanej odpovedi na farmakologickú terapiu
Klinické príznaky porúch ABR sú často veľmi vágne a nelíšia sa od klinických príznakov spojených s inými dôležitými ochoreniami. Preto je analýza krvných plynov pri ich diagnostike esenciálna. Pre interpretáciu metabolických porúch sa používajú vzorky arteriálnej, venóznej aj kapilárnej krvi, pričom v danom poradí ich relevancia pre adekvátny výsledok klesá (vysvetlené nižšie).
Metabolické poruchy ABR sú následne najčastejšie riešené aplikáciou vhodnej intravenóznej fluidnej terapie, inými farmakologickými intervenciami alebo liečbou samotnej príčiny primárneho ochorenia.
Prehľad definícií:
- Kyselina je molekula, ktorá odovzdáva vodíkový katión (H+) – ten následne prijíma molekula zásady (bázy)
- Pufer je slabá kyselina alebo zásada, ktorá pomáha ochrániť organizmus pred zmenami v pH
- primárny extracelulárny pufer je bikarbonát (hydrogen uhličitan, HCO3–),
- intracelulárne pufre sú fosfáty, proteíny, hemoglobín,
- pufrom sú napríklad aj kosti.
- pH je miera acidity (kyslosti)/alkalinity (zásaditosti), rovná sa negatívnemu algoritmu koncentrácie H+
- Acidémia je stav organizmu, kedy pH klesá pod hodnotu 7,35
- Alkalémia je stav organizmu, kedy pH stúpa nad hodnotu 7,45
- Acidóza alebo alkalóza je stav organizmu, ktorý odzrkadľuje zmeny v organizme z dôvodu odchýlok pH. Tradičný Henderson-Hasselbachov prístup klasifikuje 4 základné poruchy ABR:
- metabolická acidóza = primárny vzostup hladiny kyselín a strata zásad
- metabolická alkalóza = primárny vzostup hladiny báz a strata kyselín
- respiračná acidóza = retencia CO2 v organizme (v dôsledku produkcie CO2 kvôli zvýšenej alveolárnej ventilácii)
- respiračná alkalóza = intenzívnejšia je eliminácia CO2 z organizmu pomocou ventilácie ako samotná produkcia CO2
V organizme môžu byť okrem základných (primárnych) porúch ABR prítomné aj zmiešané poruchy ABR (napr.: kombinácie metabolických a respiračných porúch – paralelná prítomnosť metabolickej acidózy s respiračnou alkalózou).
- paO2 je parciálny tlak kyslíka prítomného v arteriálnej krvi, predstavuje mieru oxygenácie, nie ventilácie.
- paCO2 je parciálny tlak oxidu uhličitého prítomného v arteriálnej krvi. Vyjadruje najvýstižnejšiu mieru toho, akú má pacient schopnosť ventilovať. Určuje, či je v organizme prítomná respiračná acidóza alebo alkalóza. Nezabúdajme však, že CO2 je 20x rozpustnejší než O2, a preto je pre pacienta s ochorením pľúc oveľa jednoduchšie udržať si v organizme normálnu koncentráciu CO2.
- pvCO2 je parciálny tlak oxidu uhličitého prítomného vo venóznej krvi. Ak je vzorka krvi odobraná správne, táto hodnota rovnako predstavuje schopnosť ventilácie u pacienta tak, ako to určuje aj hodnota paCO2.
- BASE EXCESS/DEFICIT (BE):
- je odrazom metabolickej zložky acidobázickej rovnováhy, ktorá zahŕňa všetky pufračné systémy organizmu
- určuje koľko báz je potrebné organizmu buď dodať alebo odobrať na to, aby bolo dosiahnuté normálne pH pri normálnej telesnej teplote
- je hodnotou , ktorá určuje, či je v organizme prítomná acidóza alebo alkalóza

Tab. 1 Referenčné hodnoty analýzy krvných plynov u psa a mačky
Respiračné funkcie – stručný prehľad
Respiračné funkcie organizmu, alebo presnejšie povedané schopnosť pacienta oxygenácie (okysličenia) a ventilácie, môžu byť tiež hodnotené pomocou analýzy arteriálnych krvných plynov. Avšak vo väčšine prípadov môže byť pre túto diagnostiku použitá aj venózna krv, z ktorej je možné posúdiť stav ventilácie (CO2 vo venóznej krvi má o 5 mmHG vyššie hodnoty ako CO2 v arteriálnej krvi).
Na ďalšie posúdenie respiračných funkcií sa využíva klinické vyšetrenie pacienta a pulzná oxymetria pre detekciu hypoxémie. Analýza arteriálnych krvných plynov však zostáva na túto diagnostiku zlatým štandardom.
- Pacient s hypoxémiou môže byť cyanotický, avšak tento príznak sa ukáže až keď dochádza k silnej hypoxii a často je evidentný až pred blížiacim sa exitom. Preto sa toto posúdenie nepovažuje za spoľahlivý indikátor adekvátnej oxygenácie.
- Dychovú frekvenciu a hĺbku dýchania je na relevantné posúdenie respiračných funkcií zložité používať ako spoľahlivé parametre, pretože môžu byť ovplyvňované rôznymi inými faktormi (napr.: bolesť, vzrušenie, strach a metabolické poruchy, ale aj sedácia alebo samotná anestézia).
Ak sa pacient nachádza v respiračnej tiesni, pred samotným odberom vzorky krvi na analýzu krvných plynov by mu mala byť poskytnutá suplementácia kyslíka.
Analýza krvných plynov – odber vzorky krvi a manipulácia s ňou
Na súčasnom trhu je dostupných mnoho rôznych analyzátorov krvných plynov, od malých prenosných zariadení až po veľké laboratórne zariadenia. Dôležitým krokom pre analýzu krvných plynov však je samotný odber vzorky krvi. Tá musí byť odobraná a následne manipulovaná správnym spôsobom, hlavne pokiaľ ide o venóznu krv. Do úvahy prichádza niekoľko možných chýb vzoriek:
- Ak je vzorka odoberaná z periférnej cievy pacienta so slabou perfúziou, vzorka vtedy môže skôr predstavovať acidobázický status danej končatiny ako situáciu v celom organizme.
- Ak je cieva pri odbere vzorky z končatiny na niekoľko minút komprimovaná, môže sa v danej vzorke prejaviť laktátová acidóza, špecifická len pre danú končatinu
- Ak vzorka nie je ihneď po odbere analyzovaná alebo schladená ľadom na teplotu 4°C (max. na 2 hodiny), nasledujúci bunkový metabolizmus červených krviniek bude ďalej spotrebúvať O2 a produkovať CO2, stúpne pH krvi. V momente keď sa vyčerpá všetok O2, zvýši sa koncentrácia kyseliny mliečnej, ktorá ďalej potom znižuje pH a aj HCO3– a BE.
- Ak je vzorka krvi vystavená kontaminácii vzduchom (napr.: skúmavka krvi so vzduchovou bublinou alebo netesná ihla), vzdušný kyslík sa rozpustí vo vzorke, kým CO2 sa zas vytlačí zo vzorky von, čo následne ovplyvňuje hodnotu paO2, paCO2 a pH, ktoré sú potrebné na kalkuláciu hodnoty HCO3– a BE. Vzorka sa tak stáva nevhodnou na presné posúdenie acidobázického stavu organizmu.
Vzorka venóznej krvi:
- Vzorka venóznej krvi by mala byť ideálne odobraná pomocou centrálneho katétra priamo z vena cava cranialis alebo caudalis alebo priamo jugulárnou venopunkciou tak, aby bola čo najreprezentatívnejšia pre posúdenie celkovej acidobázickej rovnováhy a respiračných funkcií.
- Vzorka musí byť náležite uzavretá (aby sa predišlo kontaktu so vzdušným kyslíkom) a ihneď spracovaná na analýzu. Ak nie je možné vzorku analyzovať ihneď, je možné ju do analýzy schladiť uložením v ľade (4°C max. 2 hodiny).
- Vzorka môže byť analyzovaná ihneď buď bez pridania antikoagulačnej látky alebo odobraná do striekačky s heparínom, až kým nebude analyzovaná.
- Na prípravu vzorky s heparínom natiahnite 3 ml injekčnú striekačku malým množstvom tekutého heparínu; potom nasajte vzduch až po značku 3 ml injekčnej striekačky a niekoľkokrát nasilu vytlačte heparín. Zatiaľ čo sa väčšina heparínu zo striekačky odstráni, zostane v nej dostatok na adekvátnu koaguláciu krvi. Toto zvyškové množstvo heparínu však je schopné ovplyvniť hodnotu meraného ionizovaného vápnika vo vzorke (preto heparinizovaná venózna krv nie je celkom vhodná na relevantné posúdenie hodnoty Ca++).
Vzorka arteriálnej krvi:
Odber vzorky arteriálnej krvi u zvieracieho pacienta je pri analýze krvných plynov významný a často náročný úkon. U nesedovaných pacientov je dobre použiť lokálne anestetikum pre znecitlivenie miesta vpichu, pretože často ide o pomerne bolestivý zákrok. V závislosti od individuálnych vlastnosti pacienta môžu byť na odber arteriálnej krvi použité nasledujúce cievy:
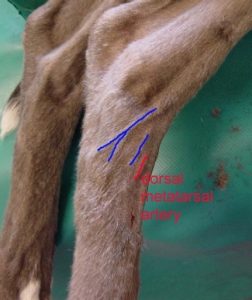
- U psov bez sedácie/anestézie: Metatarzálna vetva dorzálnej pedálnej artérie (preferovaná, Obr.1)
- Anestetizovaní pacienti: + arteria coccygealis, auricularis, a. radialis (odber z týchto artérií nie je dobre tolerovaný u pacientov bez sedácie/anestézie)
- Malí pacienti: arteria femoralis (preferovaná) – ak je po odbere vzorky prítomné značné krvácanie, toto samotné je náročnejšie na nasledovný manažment (zastavenie pomocou kompresie) – preto toto miesto použite len v prípade, ak nie je možný odber z iných artérií.
- Mačky: U mačiek je arteriálna punkcia obzvlášť náročná kvôli veľkosti ich artérií a ich komplikovanej fixácii. Preto by mali byť mačky pred odberom sedované alebo anestetizované. Najbežnejšie používanými cievami pre odber u mačiek sú arteria dorsalis, pedalis, a. femoralis, a. coccygealis.

Obr. 1 Zobrazenie lokalizácie arteria pedalis dorsalis a jej vetiev, arterias metatarsales dorsales.
Pacienti v respiračnej tiesni nemusia dobre znášať polohovanie a fixáciu pri samotnom odbere vzorky. U týchto pacientov sa na analýzu odporúča použiť vzorka venóznej krvi v kombinácii s pulznou oxymetriou.
Odber vzorky arteriálnej krvi pre analýzu krvných plynov – POSTUP:
Odber vzorky arteriálnej krvi si vyžaduje viac zručnosti, ako pri odbere venóznej vzorky. Artériu nie je možné vidieť voľným okom, môžeme ju registrovať nahmataním jej pulzácie (s výnimkou a. auricularis, ktorú je možné často vidieť a vnímať ako prebieha do stredu dorzálnej časti ušného boltca). Pri získavaní zručnosti pri odbere arteriálnej krvi je užitočná prax najmä u pacientov v anestézii a najmä precízna znalosť anatomického umiestnenia tepien.
Čo budete potrebovať?
- Špeciálnu lítium-heparínovú striekačku s ihlou na analýzu krvných plynov (najčastejšie rozmer 25)
Alebo
- Ihla veľkosti 25 a striekačka s objemom 3 ml pokrytá zvnútra tekutým heparínom (podľa popisu pri odbere venóznej krvi)
POSTUP:
- Vystrihajte/vyhoľte a asepticky pripravte miesto vybrané pre arteriálnu punkciu (najbežnejšie používaným miestom je metatarzálna vetva dorzálnej pedálnej artérie).
- Umiestnite pacienta do polohy ležmo pomocou úchopu za končatiny.
- Nedominantnou rukou nahmatajte pulz medzi druhým a tretím metatarzom.
- Dominantnou rukou pomaly vpichujte ihlu v uhle 30 ° až 40 °. Pokračujte veľmi pomaly v posúvaní ihly a sledujte prvý náznak krvi v hrote ihly.
- Ak nie je v hrote viditeľná žiadna krv, pomaly vytiahnite ihlu dozadu a sledujte opäť prítomnosť krvi (je možné, že ihla prešla cez cievu a pri postupnom vyťahovaní ihly je vzorku možné znovu získať).
- V opačnom prípade, ak je ihla vpichnutá veľmi povrchovo a krv sa nedarí odobrať, presmerujte ju tak, aby vnikla do hlbších vrstiev v smere ku artérii.
- Akonáhle je náznak krvi v ihle viditeľný:
- Ak sa používa injekčná striekačka pre odber krvi na analýzu krvných plynov, nechajte ju automaticky samovoľne naplniť.
- Ak sa používa 3 ml injekčná striekačka, jemne krv nasajte povytiahnutím piestu.
- Po získaní potrebného množstva krvi vyberte ihlu z tepny a zatlačte na miesto vpichu, následne naň umiestnite kompresný obväz aspoň na dobu 30 až 60 minút
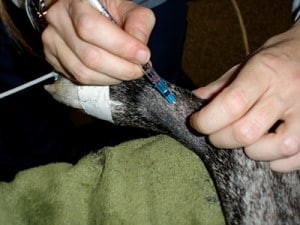
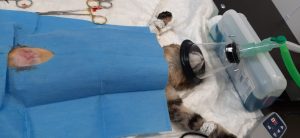
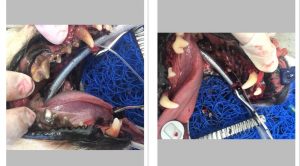
Obr. 2 Odber arteriálnej krvi pre analýzu krvných plynov z dorzálnej pedálnej artérie u 2-ročného kastrovaného psa pitbulteriéra v anestézii kvôli odstráneniu cudzieho telesa zo žalúdka.
Umiestnenie arteriálneho katétra – POSTUP:
Arteriálne katétre sú mimoriadne užitočné u pacientov, ktorí si vyžadujú opakovaný odber vzorky pre analýzu arteriálnych krvných plynov (napríklad u pacientov s mechanickou pľúcnou ventiláciou).
- Odporúča sa použitie sedatív alebo lokálneho anestetika, (napr.: lidokaín). Ideálne je umiestnenie katétra v celkovej anestézii.
- Vystrihajte/vyhoľte a asepticky pripravte miesto vybrané pre arteriálnu punkciu (najbežnejšie používaným miestom je metatarzálna vetva dorzálnej pedálnej artérie). Ostatné artérie ( a. coccygealis, a. auricularis, a. radialis, a. femoralis) môžu byť tiež katetrizované; katétre na týchto miestach sú však horšie tolerované u pacientov bez sedácie/anestézie (častejšie používané počas anestézie).
- Umiestnite pacienta do polohy ležmo pomocou úchopu za končatiny.
- Pomocou krátkeho intravenózneho katétra (zvyčajne s priemerom 22) preniknite kožou medzi druhým a tretím metatarzom a približne 1/3 distálne od päty po metatarzofalangeálny kĺb. Ak je pokožka veľmi hrubá, urobte pred zavedením katétra do kože malý zárez pomocou šikmého hrotu ihly s rozmerom 20.
- Tepna prechádza dorzolaterálne (Obr. 3), približne v 30° uhle ku kolmej čiare vedenej medzi týmito 2 kĺbmi; katéter primerane natočte.
- Akonáhle arteriálna krv prenikne do katétra, vsuňte ju do tepny a vyberte ihlu.
- Pripojte T-konektor na katéter, vstreknite malé množstvo (1 ml – 1,5 ml) heparinizovaného fyziologického roztoku a prilepte katéter na miesto, ako pri zavedení štandardného i.v. katétra.
- Označte katéter ako arteriálny, aby ste zabránili neúmyselnému podaniu injekčných liečiv cez katéter.
Arteriálne katétre u mačiek: Arteriálne katétre sa u mačiek ťažko umiestňujú kvôli malej veľkosti ciev. Mačky majú aj menší rozsah kolaterálneho obehu v distálnych končatinách, a preto majú väčšiu predispozíciu k ischemickému poškodeniu chodidla alebo chvosta po arteriálnej katetrizácii. Arteriálne katétre by sa teda u nich nemali nechať zavedené dlhšie ako 6 až 8 hodín.
Referencie:
Waddell Lori S., DVM, Diplomate ACVECC: The Practitioners Acid-Base Primer: Obtaining and Interpeting Blood Gases. Clinical Pathology, Todays Veterinary Practice, 2013, vol. 3, iss. 6, 25 – 30.
tvpjournal.com












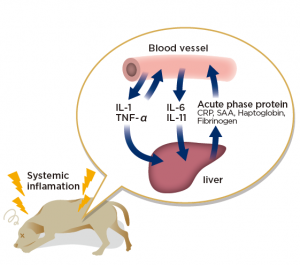
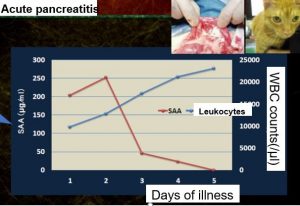

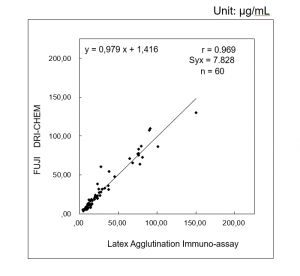








 Interpretácia nameraných hodnôt v-PRG
Interpretácia nameraných hodnôt v-PRG